要旨
微生物によって生産されるペプチド化合物の多くは、非リボソームペプチド合成酵素(NRPS)によって生合成される。NRPSは、タンパク性アミノ酸以外のアミノ酸も基質として利用できることから、合成されるペプチド化合物の化学構造は多様である。その一方で、ペプチド鎖長(アミノ酸残基数)については、NRPSのドメイン構造によって厳密に制御されており一般的に多様性は認められない。しかし、最近我々は、ペプチド鎖長に多様性があり、また、単純な化学構造であるε-poly-L-lysine(25~35残基)とstreptothricin(ST)のβ-リジンペプチド構造(1~7残基)(図 11A)が、新奇反応メカニズムを有するNRPSによって合成されることを見出した(Nature Chem. Biol., 4, 766–772, 2008; Nature Chem. Biol., 8, 791–797, 2012)。
本講演では、これら新奇NRPSの反応メカニズムについて紹介するとともに、最近我々が見出した新規tRNA依存性ペプチド合成酵素(図 11B)についてもその興味深い反応機構を紹介する(Appl. Environ. Microbiol., 82, 3640–3648, 2016)。
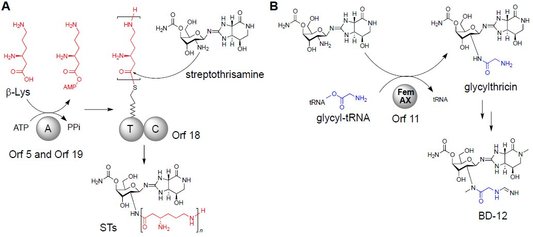 図 1 STのβ-リジンペプチド構造(A)およびグリシン側鎖(B)の生合成メカニズム
図 1 STのβ-リジンペプチド構造(A)およびグリシン側鎖(B)の生合成メカニズム
印刷用PDFファイル(281 825 バイト) | ページ先頭へもどる
2018年10月16日作成


