癌は日本における死亡原因の第一位であり、早期発見とともに様々な治療法を組み合わせた集学的治療や、患者の病態に合わせた個別化治療が求められている。代表的な治療法は、外科治療や化学療法、放射線治療等であるが、これらの治療とマイクロ波との融合が注目されている。マイクロ波は生体を非侵襲に透過し、癌細胞を容易に高温にして死滅誘導するため、凝固焼灼療法やハイパーサーミアに利用されている。一方でマイクロ波は、吸収能の高い物質を優先的に加熱するため、多くの化学反応が熱伝導加熱よりも低温かつ短時間で進行する。そのため生体にマイクロ波を照射すると、熱伝導加熱では未観測の生命現象や細胞摂動が起きると推測される。
我々は、腫瘍へのマイクロ波照射を精密制御することで、現行より低温でも効率良く癌細胞を死滅できると考えた。これまでの予備知見から、37°C管理下でもマイクロ波照射により癌細胞を死滅誘導できた。その死滅は、熱ストレスとは異なる独自の経路を経て進行した一方で、癌細胞特異的な経路ではなかった。またマイクロ波の吸収能は正常細胞と癌細胞ともに同程度であった。以上から、本現象を癌治療へ応用するためには、狙った癌細胞のみを死滅誘導する必要がある。更に集学的治療に加え、治療と同時に癌細胞の状態を確認・診断すること(=セラノスティックス)が必要と考えた。
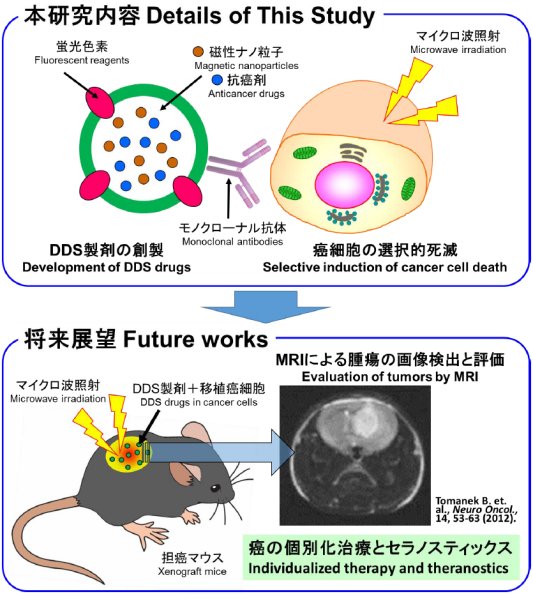
そこで本研究では、多機能を有するDrug Delivery System(DDS)製剤を開発し、癌細胞の選択的かつ効率的な死滅とその評価法を確立する。具体的には、蛍光色素を含有したDDS製剤を、モノクローナル抗体により癌細胞の特異的分子に局在させる。またリポソーム内に磁性ナノ粒子と抗癌剤を包埋し、癌細胞のみに取り込ませる。ここにマイクロ波を照射し、癌細胞特異的な死滅を誘導すると同時に、抗癌剤との併用効果を期待する。将来的には、本DDS製剤をin vivoに投与し、磁性ナノ粒子を造影剤としてMRIに適用することで、腫瘍の高感度画像検出や機能評価を可能とする。
ページ先頭へもどる
2018年11月1日作成,2019年2月8日更新