
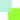 第175回定例オープンセミナー資料
第175回定例オープンセミナー資料
2013年12月11日
題目
セルロースの酵素糖化の鍵となるβ-グルコシダーゼの結晶構造:糖鎖の鎧をまとった酵素のかたち
Crystal structure of β-glucosidase as a key enzyme in enzymatic degradation of cellulose: An enzyme dressed in armor made of glycans
発表者
伏信進矢 (東京大学大学院農学生命科学研究科・教授)
関連ミッション
要旨
セルロースは地上に最も多く存在する再生可能なバイオポリマーであり、これを酵素によってグルコースなどの単糖に分解し発酵などに用いることができれば、バイオ燃料の製造などのバイオリファイナリーに利用可能となる。セルロースを分解する一群の酵素はセルラーゼと総称され、結晶セルロースの末端から二糖であるセロビオースを遊離するセロビオヒドロラーゼ(CBH)、セルロース分子鎖が比較的乱れた領域をランダムに切断するエンドグルカナーゼ(EG)、セロビオースや短い鎖(セロオリゴ糖)の末端からグルコースを生成する β-グルコシダーゼ(BGL)などが主要なメンバーである(図 1)。
図 1: セルロースの糖化過程
現在コスト面などから最も有望なセルラーゼ製剤は Trichoderma reesei を主とする糸状菌由来の酵素であり、この菌はその体外に活性の高いセルラーゼを大量に分泌する。いくつかの企業が競って優秀なセルラーゼ製剤を販売しているが、ここ数年の技術開発により、その糖化能力は大幅に向上している。その一つは、添加することによりセルラーゼ活性を「ブースト」させる溶解性多糖モノオキシゲナーゼ(LPMO)の利用である。LPMO はごく最近発見された銅結合型酵素で、結晶セルロース表面の鎖を酸化的に切断することにより CBH や EG の作用を助けていると言われている。もう一つは、古くから言われていることであるが、Trichoderma 属糸状菌のセルラーゼは元々 BGL 活性が比較的弱く、BGL を添加することにより単糖生産能力が大幅に向上する。BGL はいくつかの糖質加水分解酵素(GH)ファミリーに見られるが、セルラーゼ添加酵素としての BGL には、セロビオースに対して活性が高く遺伝子発現の点で有利な、糸状菌由来の GH3 ファミリーに属する BGL が用いられている。特に、Trichoderma 属自身が持つ BGL よりもセロビオース分解活性の高い Aspergillus 属の BGL を添加酵素として利用することが多い。
本発表では、実際に Trichoderma reesei セルラーゼ製剤への添加酵素として利用されている Aspergillus aculeatus の BGL の結晶構造について発表する。このように応用上極めて重要な酵素であるにもかかわらず、糸状菌由来の GH3 BGL の結晶構造はこれまで未解明であった。その理由の一つは、この酵素が多数の糖鎖で覆われており、一般的に結晶化が困難だと思われてきたことである。我々は幸運なことに、A. aculeatus の BGL で高分解能の X 線回折が得られる結晶を得ることに成功した。その構造を明らかにしたところ、分子表面に多数の糖鎖が存在することが明らかになった(図 2)。とくにその一つではこれまでタンパク質の結晶構造で確認された最大の N-リンク糖鎖である (GlcNAc)2-Man8 が観測された。このような多量の糖鎖は、この酵素が作用する環境での不溶化を防ぎ安定性の向上に寄与していると予想される。
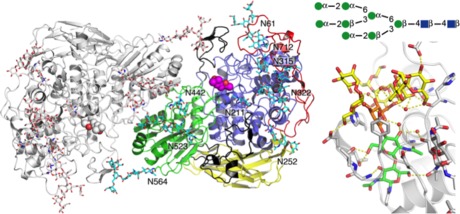
図 2: A. aculeatus BGLの全体構造(左)と、Asn322に結合した最大のN-リンク糖鎖(右下)およびその模式図(右上)
|

